硫酸亚铁晶体(FeSO4•7H2O)在医药上常作补血剂,某课外研究小组测定该补血剂中铁元素的含量,其实验步骤如下:

请回答下列问题:
(1)证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液,现象为 ,步骤Ⅱ中发生反应的离子方程式为 .
(2)写出步骤Ⅳ中一系列处理的操作步骤:过滤、 、灼烧、 、称量.
(3)若实验无损耗,则每片补血剂中含铁元素 g.
(4)该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定.
①该实验原理用离子方程式可表示为 .
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 .
③该实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
④若取m g该补血剂用0.1mol•L﹣1的KMnO4溶液进行滴定,在此实验过程中共用去KMnO4溶液100mL,则该补血剂中铁元素的质量分数为 .
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:


按下列合成步骤回答问题:
(1)在
中加入15
无水苯和少量铁屑,在
中小心加入4.0
液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体。继续滴加至液溴滴完,装置
的作用是;
(2)液溴滴完后,经过下列步骤分析提纯:
①向
中加入10
水,然后过滤除去未反应的铁屑;
②滤液依次用10
水、8
10%的
溶液、10
水洗涤。
溶液洗涤的作用是
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,
的容积最适合的是(填入正确选项前的字母)。
A.25
B. 50
C.250
D.500
次硫酸氢钠甲醛(
)在印染、医药以及原子能工业中应用广泛。以
、
、
和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图 所示) 加入一定量
和水,搅拌溶解,缓慢通入
,至溶液
约为4,制得
溶液。步骤2:将装置
中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 ~ 90益下,反应约3
,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。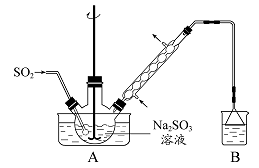
(1)装置
的烧杯中应加入的溶液是。
(2)①步骤2 中,反应生成的
会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是。
②冷凝管中回流的主要物质除
外还有(填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有、(填仪器名称)。
②滤渣的主要成分有、(填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是。
(12 分)利用石灰乳和硝酸工业的尾气(含
、
)反应,既能净化尾气,又能获得应用广泛的
,其部分工艺流程如下: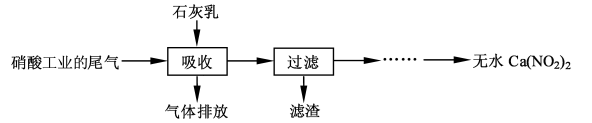

(1)一定条件下,
与
存在下列反应:
+
=
),其平衡常数表达式为
=。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋), 其目的是;滤渣可循环使用,滤渣的主要成分是(填化学式)。
(3)该工艺需控制
和
物质的量之比接近1 颐1。若
:
>1 颐1,则会导致;若
:
<1 颐1,则会导致。
(4)生产中溶液需保持弱碱性,在酸性溶液中 会发生分解,产物之一是 ,其反应的离子方程式为。
[广东卷]氟乙酸甲酯是一种重要的医药中间体,发生过使人中毒致死的案例。某合成反应如下:Cl-CH2COOCH3+ KF→F-CH2COOCH3 +KCl。该反应的产率等受多种因素的影响,下表是KF的干燥方式对反应的影响:
| 序号 |
KF干燥方式 |
氯乙酸甲酯转化率/% |
氟乙酯甲酯收率/% |
| ① |
未干燥 |
41.2 |
30.9 |
| ② |
真空干燥3h |
61.6 |
55.7 |
| ③ |
真空干燥5h |
77.5 |
73.0 |
| ④ |
600℃烘8h |
71.3 |
63.4 |
| ⑤ |
600℃烘12h |
79.2 |
70.7 |
| ⑥ |
600℃烘8h再150℃真空干燥3h |
90.5 |
82.3 |
各原料价格:ClCH2COOCH3:1.16元/mol,KF:0.85元/mol。
(1)由表可看出,最佳干燥方式为 。(填序号)
(2)影响氟乙酸甲酯收率的因素 。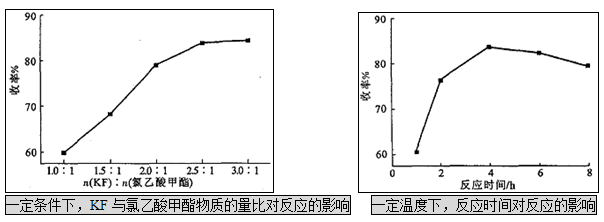
(3)为提高氟乙酸甲酯收率,应选择的比率是 ,理由是
(4)合适的反应时间是 ,时间不宜过长的原因可能是
(5)写出氟乙酸甲酯完全水解的方程式
[广东卷] 某小组用如图装置及药品(部分略去)探究工业制硫酸的过程。
(1)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是
(2)实验时A中氧气导管冒出的气泡与SO2导管冒出的数量相近,目的是: ,SO3在装置 中被吸收,装置D中盛放的溶液是: 。
(3)实验结束后,为使装置中残留的SO2、SO3被充分吸收,操作方法是
(4)有人设想用如图所示装置,根据电化学原理将SO2转化为重要的化工原料。A为SO2,B为O2,则负极是 (填左、右),负极的电极反应为 ;一段时间后,溶液的pH变 。