如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状下测定)。
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。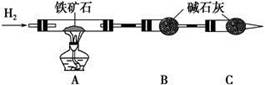
(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。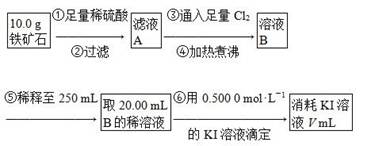
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)。
(2)D装置的作用是。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是。
A亚硝酸盐是还原剂
B维生素C是还原剂
C维生素C将Fe3+还原Fe2+
D亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A 测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式。
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2乙:MgO、NO2、O2
丙:Mg3N2、O2丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O,针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭K,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明。
② 称取Mg(NO3)2固体3. 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先______然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是_____________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】
用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数。
【方案3】按以下步骤测定样品中A1N的纯度: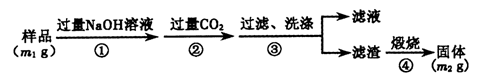
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
【化学与技术】
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是,其中发生反应的化学方程式为。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是、。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是、。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是;在合成硝酸的吸收塔中通入空气的目的是。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| 注意事项 |
理由 |
|
| ① |
||
| ② |