NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
| 所加试剂 |
预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl+ Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。
(1)实验室制取气体时,确定发生装置需要考虑的两个因素有 (填序号);
| A.反应物的状态 | B.气体的密度 |
| C.反应的条件 | D.气体的溶解性 |
(2)某实验室的仪器柜里有如下仪器:
写出图中标号①仪器的名称 。实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是 (填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为 。为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是 (填序号),该装置的最大优点是 。
(4)某实验小组还利用下图装置对实验室制取 的速率快慢进行了研究。他们实验时所用的试剂和使用的反应条件如下表所示:
的速率快慢进行了研究。他们实验时所用的试剂和使用的反应条件如下表所示: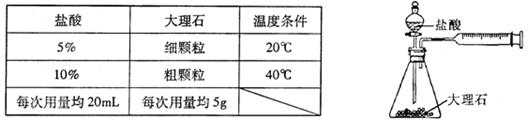
实验小组同学设计的实验方案部分如下表,请根据表中信息帮助填写完整。
实验探究时,他们每次收集 气体均为40mL,则实验中他们还应记录的实验数据是 。
气体均为40mL,则实验中他们还应记录的实验数据是 。
下图是根据某次实验数据作出的 和时间变化的关系曲线,请分析在80秒以后,产生
和时间变化的关系曲线,请分析在80秒以后,产生 逐渐减慢的可能原因: 。
逐渐减慢的可能原因: 。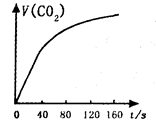
(9分)(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。其示意图如下:
①物质X是 (填名称)。
②写出反应Ⅰ中发生反应的分步的化学方程式 、 。
③上述一系列转化过程中,没有涉及的基本反应类型是 。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
(3)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式: 。
(5分)实验室用下图所示装置的部分或全部组合后完成如下实验,请回答下列问题:
(1)①小明要证明鸡蛋壳的主要成分是碳酸盐,他将A装置中的导气管a与C装置中的导气管相连,当装置C中产生 现象时即达到实验目的。
②若将A装置中的药品换成稀硫酸和锌粒,产生的H2经干燥后用D装置收集,当D装置的瓶口向下时,导管口的连接顺序应是a→b→c→ (填“f”或“g”)。
(2)实验室用大理石和稀盐酸反应制备CO2。下列装置中属于能用于制备CO2的发生装置,且符合启普发生器工作原理的是(省略了夹持仪器) (填序号)。
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程图如下所示: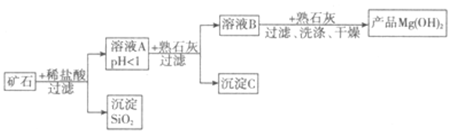
(1)写出Fe2O3与盐酸反应的方程式:________________,此反应常用来除铁锈;写出一条预防钢铁锈蚀的方法:_______________。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为_________。
| 氢氧化物 |
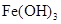 |
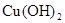 |
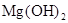 |
| 开始沉淀的pH |
1.5 |
4.2 |
8.6 |
| 完全沉淀的pH |
3.2 |
6.7 |
11.1 |
(3)溶液B中一定含有的溶质为__________(填化学式)。
(4)写出溶液B中加入熟石灰,生成产品的化学方程式:________________。
下图是实验室制取某些常见气体所使用的一些装置和仪器。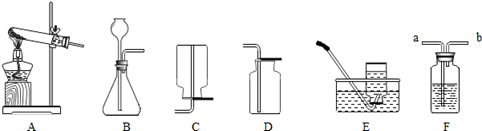
(1)写出实验室制取氧气的一个反应原理 ,用该方法制取氧气的发生装置是 ,收集装置可选择 。
(2)实验室制取二氧化碳,应选择的发生装置是 ,收集装置是 。欲收集满一瓶二氧化碳气体,需要用燃着的小木条放在集气瓶口,若观察到火焰熄灭,则接下来应进行的操作是 。若火焰不熄灭,则说明二氧化碳还没有收集满,应该继续收集。
(3)F装置的用途很广,下列关于该装置的用法正确的是 (将正确答案的序号填在横线上)。
| A.当装置内盛满水,若收集氢气,气体从b通入,若收集氧气,气体从a通入。 |
| B.当装置内盛有一半的浓硫酸时,除去氢气中的水蒸气,气体从b通入 |
| C.当装置内盛满氧气时,将装置内的氧气排除来,水从a通入 |
| D.当装置内盛有一半的水时,观察给病人输氧气的速率,a端连接氧气钢瓶,b端连接病人 |