1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家,大气中的臭氧层可滤除大量的紫外线,保护地球上的生物,氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3),有关反应为:
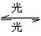

 O3 O2+O Cl+O3====ClO+O2 ClO+O====Cl+O2
O3 O2+O Cl+O3====ClO+O2 ClO+O====Cl+O2


 总反应:2O3====3O2
总反应:2O3====3O2
 (1)在上述臭氧变成氧气的反应过程中,Cl是
(1)在上述臭氧变成氧气的反应过程中,Cl是

| A.反应物 | B.生成物 | C.中间产物 | D.催化剂 |
 (2)O2和O3之间的关系是 。
(2)O2和O3之间的关系是 。
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是.
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称)。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu(填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:;阴极:。
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
I.(1)现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为。 (2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
| 起始浓度( mol/L) |
C(NH3) |
C(O2) |
C(NO) |
C(H2O) |
| 甲 |
1 |
2 |
0 |
0 |
| 乙 |
4 |
8 |
0 |
0 |
| 丙 |
0.2 |
x |
y |
z |
①恒温恒容下,平衡时NH3的转化率甲乙。(填“>”、“=”、或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=,y=,z= .
(3)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g) N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
N2O4(g)△H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1< T2,则a1_a2。
A.大于 B.小于 C.等于 D.以上都有可能
(4)2.24L(标准状况)氨气被200 mL l mol/L HNO3溶液吸收后,反应后溶液中的离子浓度关系是。
Ⅱ.三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、 NO、 HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:。反应过程中,氧化剂和还原剂物质的量之比为。
(2)若反应中生成0.2mol HNO3,转移的电子数目为。
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe H2
H2 Cu ②CuO
Cu ②CuO CuSO4
CuSO4 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是。
化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握一项基本技能。请按照要求完成下列方程式。
Ⅰ.生活中很多现象和原理都可以用化学反应来解释:写出 泡沫灭火器反应原理 的离子方程式:
________________________________________________________________________
Ⅱ.某一反应体系有反应物和生成物共六种物质:N2O.FeSO4.Fe(NO3)3.HNO3.Fe2(SO4)3和H2O。写出该反应的化学方程式:
________________________________________________________________________
Ⅲ.有一些反应,表面上似乎违背了反应的基本原理,事实上他们是完全符合反应基本原理的。请完成下列反应:
① 写出 两种弱酸溶液混合反应后,溶液的酸性减弱 的化学方程式
________________________________________________________________________
② 写出 一种弱酸溶液与一种盐溶液混合发生复分解反应,生成强酸 的离子反应方程式
研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)  2SO3(g)∆H=-196.6 kJ·mol-1
2SO3(g)∆H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)∆H=-113.0 kJ·mol-1
2NO2(g)∆H=-113.0 kJ·mol-1
(ⅰ)则反应NO2(g)+SO2 (g) SO3(g)+NO(g)的∆H= kJ·mol-1。
SO3(g)+NO(g)的∆H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
A.每消耗1 mol SO3的同时生成1 mol NO2 B.体系压强保持不变
C.混合气体颜色保持不变D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。
平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”.“<”或“=”)

(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应∆H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应∆H 0(填“>”或“ <”)。