硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得S22-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与S22-也完全转化为S2O32-。问: S+SO2+OH-完全转化为S2O32-的离子方程式____________________
S+SO2+OH-完全转化为S2O32-的离子方程式____________________ amol S最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
amol S最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________ 若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为 _________。
_________。
在恒温恒容的密闭容器中通入1 molN2和X molH2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
(1)起始时充入H2物质的量为_____________mol;
(2)该反应的热化学方程式为_________________________________________;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是_______________________。
②若c="2" mol,在相同条件下达到平衡时,该反应吸收的热量为______________kJ。
(6分)如下图所示,关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应: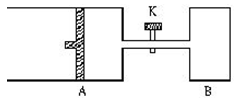
X+Y 2Z+2W+Q;ΔH<0(X、Y、Z、W均为气体),达到平衡时,VA=1.2aL。试回答:
2Z+2W+Q;ΔH<0(X、Y、Z、W均为气体),达到平衡时,VA=1.2aL。试回答:
(1)A中X的转化率αA=________。
(2)A、B中X转化率的关系:αA________αB(填“>”、“=”或“<”)。
(3)打开活塞K,一段时间后又达到平衡时,A的体积为________L(连通管中气体体积不计)。
(10分).698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)  2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。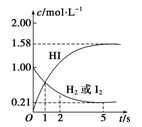
请回答下列问题:
(1)V=__________。
(2)该反应达到最大限度的时间是________,该时间内平均反应速率v(HI)=________。
(3)该反应达到平衡状态时,________(填“吸收”或“放出”)的热量为__________。
一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g)+B(g) 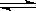 xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2 L,反应2min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①2min内,A的平均反应速率为_______________,x=;
②4min后,C的浓度___________0.8 mol/L (填“大于”、“等于” 或“小于”);
③已知平衡混合物中C的体积分数为25%,则B的转化率________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量分别为a、b、c,它们之间应该满足的关系式为________、
。
(2)若维持容器压强不变:
①达到平衡时C的体积分数__________25%(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________mol A气体和__________mol B气体。(不要求写计算过程)
将镁条在空气中燃烧的全部产物(由于空气中CO2含量少,镁条与CO2反应忽略不计)溶解在50mL浓度为1.8mol/L的盐酸中,以20mL0.9mol/L的NaOH溶液中和多余的酸,然后向溶液中加入过量的NaOH并加热,把生成的氨全部蒸发出来,用足量盐酸吸收,经测定氨的质量为0.102g,试计算原镁条的质量。