硅单质为什么在常温下性质稳定?
某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO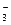 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、_______。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________ (填写金属元素符号)。
(填写金属元素符号)。
标准状况下的67.2 L HCl气体含有的HCl的物质的量为____ ____mol,分子数为_____ __,含有HCl的质量为g,将同量该气体溶于水制成500ml溶液,则溶液的物质的量浓度为。
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)向足量澄清石灰水中通入二氧化碳
请填写下表:
| 物质 |
摩尔质量 |
物质的量 |
质量 |
分子或离子数目 |
| SO2 |
2 mol |
|||
| SO42- |
6.02×1022 |
常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。
然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。则反应前H2和O2的物质的量之比为。(请简要写出计算过程)