标准状况下的67.2 L HCl气体含有的HCl的物质的量为____ ____mol,分子数为_____ __,含有HCl的质量为 g,将同量该气体溶于水制成500ml溶液,则溶液的物质的量浓度为 。
(1)家庭用漂白粉(主要成分氯化钙和次氯酸钙)平时要密封避光存放以免变质,请用化学方程式解释
, ;
(2)某人在刷厕所时,把漂白粉和洁厕灵(主要成分HCl)混合使用,结果造成氯气中毒, 反应的化学方程式, 若此反应转移电子数为4mol,则反应中被氧化的HCl的物质的量为。
已知在标况下的四种气体①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S
③13.6克H2S
④0.2molNH3用相应的序号填写下列空白:
(1)体积最大的是;(2)密度最大的是;
(3)质量最小的是;(4)含氢原子数最少的是。
维生素C又称为抗坏血酸,在人体内有重要功能。已知其结构简式如下:请回答: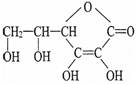
(1)维生素C的分子式为。若将苹果切碎捣烂,加水溶解提取其滤液,就能达到充分提取其中的维生素C的目的,这说明维生素C(填“能”或“不能”)溶于水。
(2)某同学在实验室探究维生素C的性质。在试管中取少量淀粉溶液,滴加几滴稀碘水,观察到溶液变为色,再向试管中滴入维生素C的溶液,发现原溶液颜色逐渐变浅。该实验说明维生素C具有性。
(3)该同学继续探究维生素C在(2)中表现的性质,可选择的试剂是(填序号)。
①KI溶液②酸性KMnO4溶液③食盐溶液④FeCl2溶液
| A.食盐 | B.食醋 | C.苹果汁 | D.葡萄糖 E.青霉素 F.环丙沙星 |
请按要求对号入座(填序号)。
富含维生素C的是;可直接进入血液,补充能量的是;应用最广泛的抗生素之一的是;既可作为调味剂,又可消毒的是;食用过多会引起血压升高、肾脏受损的。
【化学 ——选修3:物质结构】
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥形,沸点为-129 ℃;可在铜 催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N。
①与N互为等电子体的分子、离子有______、________(各举1例),由此可推知N的空间构型是______形。
②叠氮化物、氰化物能与Fe3+、Cu2+及Co3+等形成络合物,如Co[(N3)(NH3)5]SO4、[Fe(CN)6]4-。写出钴原子在基态时的价电子排布式:__________。如Co[(N3)(NH3)5]SO4、中钴的配位数为________,CN-中C原子的杂化类型是________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)===2Na(l)+3N2(g),有关说法正确的是________(选填序号)。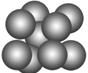
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.常温下,氮气很稳定,是因为氮的电负性小 |