现有硅酸钠、石灰石、二氧化硅三种白色粉末,使用一种试剂进行鉴别,这种试剂是
| A.烧碱 | B.盐酸 | C.氢氟酸 | D.硝酸银溶液 |
某无色溶液,仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO4─、Na+、CO32─ |
为达到预期的实验目的,下列操作正确的是
| A.可用饱和食盐水鉴别蛋白质溶液和肥皂水 |
| B.苯酚和甲醛在浓盐酸的作用下可得到体型的酚醛树脂 |
| C.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
| D.将饱和AlCl3溶液、Al(OH)3胶体加热蒸干并灼烧,产物相同 |
下表为元素周期表前三周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z、W的阴离子的还原性强弱顺序为:Z— >Y2—>W3— |
| C.最高价含氧酸的酸性强弱顺序为:H2YO4>HZO4>H3WO4 |
| D.五种元素对应的单质固态时均为分子晶体 |
工业生产中物质的循环利用有多种模式。例如: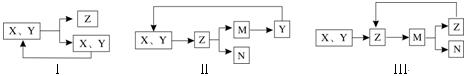

 下列表述不正确的是
下列表述不正确的是

























A.若图I为合成氨,则其中N2、H2可循环使用 |
B.若图I为合成SO3,则其中SO2、O2可循环使用 |
C.若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
D.若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中属于这种情况的是
①过量的锌与浓硫酸反应;②溶液中过量的I- 与少量的Fe3+反应;③过量的浓盐酸与碳酸钙反应;④过量的乙酸和少量乙醇在浓硫酸、加热条件下;⑤过量二氧化锰与浓盐酸在加热条件下;⑥过量的碳单质与浓硫酸在加热条件下
| A.②③④⑥ | B.②④⑤⑥ | C.①②④⑤ | D.④⑤⑥ |