下列反应的离子方程式书写正确的是( )
A.在澄清石灰水中加入少量小苏打:Ca2++2OH-+2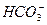 ====CaCO3↓+ ====CaCO3↓+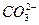 +2H2O +2H2O |
B.在KOH稀溶液中通入过量的SO2气体:SO2+OH-====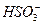 |
| C.过氧化钠和水反应:Na2O2+H2O====2Na++2OH-+O2↑ |
| D.Fe2O3溶于过量的氢碘酸溶液中:Fe2O3+6H+====2Fe3++3H2O |
若A+酸=盐+水,则A不可能属于( )
| A.氧化物 | B.单质 | C.碱 | D.电解质 |
下列叙述正确的是( )
| A.胶体区别于其他分散系的根本原因是胶体有丁达尔现象 |
| B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 |
| C.光束通过胶体和浊液时都可以看到一条光亮的通路,而溶液不能 |
| D.胶体的分散质可以通过过滤从分散剂中分离出来 |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是( )
| A.N5+离子中含有36个电子 |
| B.O2与O4属于同位素 |
| C.C60是有机物 |
| D.H2与H3属于同种元素组成的单质 |
下列说法正确的是( )
| A.淀粉、纤维素等高分子化合物均属于纯净物 |
| B.金属氧化物都是碱性氧化物 |
| C.食醋、纯碱、食盐分别属于酸、碱、盐 |
| D.丁达尔效应可用于区别溶液与胶体 |
2011年冬天,全国多个地区发生持续大雾天气,“PM2.5”数据监测纳入公众视野,“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是( )
| A.雾属于胶体,能产生丁达尔现象 |
| B.持续大雾天气给农业生产、交通运输等带来很大的影响 |
| C.大雾的形成与汽车的尾气排放没有关系 |
| D.空气中悬浮的细小颗粒物严重危害人体健康 |