下列实验过程中,溶液的pH大于7的是
| A.向NaCl溶液中滴加醋酸 | B.向KNO3溶液中滴加稀H2SO4 |
| C.向稀HCl溶液中滴加稀HNO3 | D.向NaOH溶液中滴加Na2CO3溶液 |
铝热反应可用于焊接钢轨,其反应方程式为:2Al+Fe2O3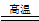 2Fe+Al2O3,该反应为
2Fe+Al2O3,该反应为
A.置换反应B.分解反应 c.化合反应D.复分解反应
下列关于硫酸的叙述正确的是
| A.浓硫酸具有吸水性 | B.稀硫酸可用铁罐贮存 |
| C.稀硫酸能使蔗糖脱水 | D.SO2溶于水,可得到稀硫酸 |
糖类与我们的日常生活息息相关。关于糖类物质的说法正确的是
A.糖类均有甜味 B.淀粉和纤维素均不是糖类
C.糖类均不可水解D.糖类都含有C、H和O元素
下列化合物中,既存在离子键又存在共价键的是
| A.碳酸钠 | B.乙醇 | C.氯化钾 | D.一氧化碳 |