1体积某烃的蒸汽完全燃烧生成的CO2比生成的水蒸气少1体积(同温同压下测定)。0.1 mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39g,求该烃的分子式。写出该烃可能的结构简式。
已知:①CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH1=-Q1
CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+O2(g) H2O(g) ΔH2=-Q2
H2O(g) ΔH2=-Q2
③H2(g)+O2(g) H2O(l) ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况),经完全燃烧恢复到常温,放出的热量是( )
H2O(l) ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况),经完全燃烧恢复到常温,放出的热量是( )
| A.0.4Q1+0.05Q2 | B.0.4Q1+0.1Q2 |
| C.0.4Q1+0.05Q3 | D.0.4Q1+0.1Q3 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1
CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1
CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1
下列说法正确的是( )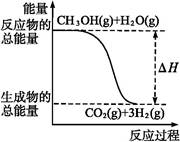
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应CH3OH(l)+O2(g) CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
已知:
①25 ℃、101 kPa时,2C(s)+O2(g) 2CO(g) ΔH="-221" kJ·mol-1
2CO(g) ΔH="-221" kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1
H2O(l) ΔH="-57.3" kJ·mol-1
又已知弱电解质电离吸热。下列结论正确的是( )
| A.C的燃烧热大于110.5 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量 |
下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH="-1" 367.0 kJ·mol-1(燃烧热) 2CO2(g)+3H2O(g) ΔH="-1" 367.0 kJ·mol-1(燃烧热) |
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH="+57.3" kJ·mol-1(中和热) NaCl(aq)+H2O(l) ΔH="+57.3" kJ·mol-1(中和热) |
C.S(s)+O2(g) SO2(g) ΔH="-269.8" kJ·mol-1(反应热) SO2(g) ΔH="-269.8" kJ·mol-1(反应热) |
D.2NO2 O2+2NO ΔH="+116.2" kJ·mol-1(反应热) O2+2NO ΔH="+116.2" kJ·mol-1(反应热) |
甲烷是一种高效清洁的新能源,0.25 mol CH4完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH="+890" kJ·mol-1 2CO2(g)+4H2O(l) ΔH="+890" kJ·mol-1 |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="+890" kJ·mol-1 CO2(g)+2H2O(l) ΔH="+890" kJ·mol-1 |
C.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 |
D.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH="-890" kJ·mol-1 2CO2(g)+4H2O(l) ΔH="-890" kJ·mol-1 |