某学生中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)即加入待测的 NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇荡,(j)边注视滴管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定,(l)记录液面刻度读数,(m)根据滴定管的两次读数得出NaOH深液体积为22mL。指出上述实验过程中的错误之处(用编号表示)___________。
(共14分)某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿
(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下: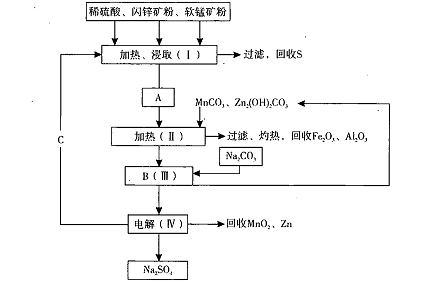
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是。
(2)加入MnCO3、Zn2(OH)2CO3的作用是:C的化学式是。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是。
I.莽草酸的结构简式如图24。请回答:
(1)写出莽草酸的分子式,其中含有的官能团名称为。
(2)该有机物分子1mol最多能和mol NaOH发生反应。
II.图25是以莽草酸A为原料的有机合成路线。

已知D的碳环上一氯代物只有两种。请继续回答下列问题:
(3)C有三种同分异构体,写出其中一种的结构简式。
(4)莽草酸A→D的反应类型是___。
(5)比莽草酸的碳原子数多一个且为苯的同系物的有机物有种。
(6)写出下列反应的化学方程式:。
①D与足量的NaHCO3溶液反应:。
②D→E(需注明18O):。
图23是C60、硅、干冰和砷化镓的晶体结构或分子模型。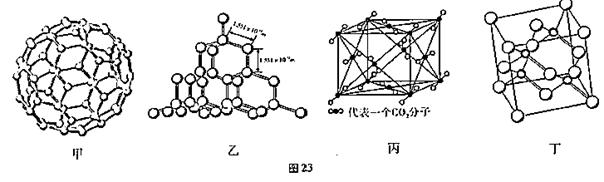
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:。
(2)从晶体类型来看,C60(如图甲)属于晶体。
(3)二氧化硅结构跟晶体硅(如图乙)的结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙晶体硅的结构,结合题中所给二氧化硅的结构信息,分析晶体二氧化硅中硅原子与共价键的个数比为。
(4)图丙是干冰的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷和丙烯分子中2号碳原子的杂化方式分别是和。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,图丁的砷化镓晶胞。试回答下列问题:
①下列说法正确的是(填序号)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As<Ga
C.电负性:As<Ga D.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为。
为了探究原电池和电解池的工作原理,某研究性学习小组分别用图所示的装置进行实验。据图回答问题。
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是(填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42—(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸银(FeO2-4)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH(填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH—4e-===2H2O+O2↑和。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn==Fe2O3+ZnO+2K2ZnO,该电池正极发生的电极反应式为。
I.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。请回答下列问题。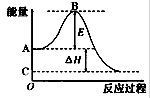
(1)图中A、C分别表示、,E的大小对该反应的反应热(填“有”或“无”)影响。
(2)已知单质硫的燃烧热为296kJ·mol-1,S(s)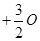 2(g)
2(g)SO3(g)△H=—395kJ·mol-1,则图中△H=kJ·mol-1。
II.某温度时,在2L密闭容器中用O2和SO2合成SO3,它们的物质的量随时间的变化如图甲所示。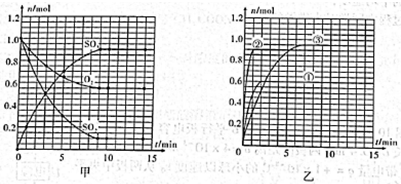
(1)列式并计算该反应在0—3min内产物SO3的平均反应速率。
(2)该反应达到平衡时反应物SO2的转化率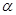 等于。
等于。
(3)计算在该温度下反应的平衡常数K=。(保留小数点后一位数字)
(4)已知,合成SO3是放热反应。图乙所示是改变实验条件后(温度、压强、催化剂)得到的SO3物质的量随时间变化的曲线,则典线①、②、③所对应的实验条件改变分别是:①,②,③。