门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因____________。冶炼金属镓通常采用的方法是____________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、____和____。
(4分)1836年,俄国籍瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应的热化学方程式,回答问题。
已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)===NH3(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH=-52.3 kJ/mol
⑤NH4Cl(s)===NH4Cl(aq) ΔH=?
则第⑤个热化学方程式中的反应热是 。
氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为,其元素的第一电离能B元素(填“>”或“<” 或“=”),原因是。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为; BeCl2中Be原子的杂化轨道类型是。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是,阴离子的结构式为。
、钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 Ti和
Ti和 Ti两种原子,它们互称为。Ti元素在元素周期表中的位置是第周期,第族;按电子排布Ti元素在元素周期表分区中属于(填s、p、d、ds或f)区元素
Ti两种原子,它们互称为。Ti元素在元素周期表中的位置是第周期,第族;按电子排布Ti元素在元素周期表分区中属于(填s、p、d、ds或f)区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡为离子晶体,晶胞的结构如右图所示,它的化学式是
(3)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,已知该配合物的配位数为6,则该配合物的配位体是。
1mol该配合物外界所含结晶水物质的量为mol。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为。
短周期元素X、Y、Z在周期表中位置关系如图:(答题时,X、Y、Z用所对应的元素符号表示)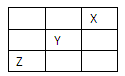
(1)x元素的单质分子式是_______,单质是_______晶体。
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为_______,属于_______晶体。
(3)Z的氢化物和Y的氢化物沸点高低顺序是:,理由:
。
(4)X、Y、Z三种元素中,电负性最大的是:。