氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”),原因是 。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是 ,阴离子的结构式为 。
铝是地壳中含量最多的金属元素,铝及其化合物应用日趋广泛。
(1)铝的原子结构示意图是
(2)氧化铝是两性氧化物,写出其与NaOH溶液反应的化学方程式
(3)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a. NaOH溶液 b. CO2 c. 氨水 d. 盐酸
最终获得铝单质是电解(填化学式),电解过程中加入冰晶石的作用是
(4)下图表示将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系(已知Ba(AlO2)2:可溶),最先与CO2反应的物质是 ,ab段反应的离子方程式为
(5)某Mg-Al合金是一种潜在的储氢材料。73.2g该合金恰好溶解于1.4 L 5. 0mol·L-1 HCl溶液,则合金中Mg和Al的物质的量之比为 。
(1) 物质的量浓度分别为 c 和 5c 的硫酸溶液,按等质量混合均匀后,混合溶液中硫酸的物质的量浓度为( )
| A.3c | B.6c | C.﹥ 3c | D.﹤3c |
(2)在 25℃、 101kPa 条件下,将 15LO2通入 10LCO 和 H2的混合气中, 使其完全燃烧,干燥后,恢复至原来的温度和压强. ①若剩余气体的体积是 15L,则原 CO 和 H2的混合气中 V(CO)="_________" L, V(H2)="________" L.
②若剩余气体的体积为 a L,则原 CO 和 H2的混合气中 V(CO):V(H2)=___________. ③若剩余气体的体积为 aL,则 a 的取值范围是_______________。
亚硝酸钠外观与食盐相似, 有咸味, 误食会引起中毒, 致死量 0.3g~~0.5g. 工业 用盐中含有亚硝酸钠. 已知 NaNO2能发生如下反应:________NO2- + ________I- + __________H+ ="________NO" + ________I2 + ________H2O 请回答下列问题
(1)配平上面离子方程式(在“ _______” 上填上系数)
(2)某工厂废液中含有 3%~5%的 NaNO2, 直接排放会造成水体污染, 加入下列物质 中的某一种就能使 NaNO2转化为不引起污染的 N2,该物质是____________
| A.NaCl | B.H2SO4 | C.NH4Cl | D.H2O2 |
发生反应的离子方程式为___________________________________ .
(3)在反应 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2 ↑ +8H2O中 ,若生成 71gCl2,则被氧化的 HCl 的质量是_______g,转移的电子数是_____________________。
(1)下图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后, 产生 CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。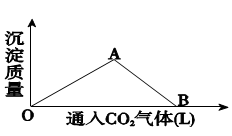
试回答:OA段所表示的反应离子方程式是:____________,AB段所表示的反应化学方程式是: __________________________,将B处生成的溶液煮沸,可见到的现象是________________________
(2)有碳酸钠和碳酸氢钠固体混合物 3.24 g。结合内容回答: ①除去该混合物中的碳酸氢钠可采取的方法是________________。 ②若将该混合物加热至质量不再变化时, 剩余固体质量为 2.62 g。原混合物 中碳酸钠的质量分数为 __________(保留小数点后一位)。
以下为中学化学中常见的物质:①Cu ②NaCl 固体 ③NaHSO4固体 ④SO3⑤稀 H2SO4⑥C2H5OH ⑦CaCO3固体 ⑧BaSO4固体 ⑨熔融 NaOH ⑩ 氨水 请按下列分类标准回答问题。(填写代号)
(1)能导电的是_________________________
(2)属于强电解质的是_________________________
(3)书写下列物质水溶液的电离方程式:
NaHSO4=_________________________
NaHCO3=_________________________
(4)书写NaOH溶液与少量 Ca(HCO3)2溶液反应的离子方程式:_________________________