某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,你认为原因是 ;
(2)4~5 min时间段的反应速率最小,你认为原因是 ; (3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)= ;
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)= ;
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
| A.H2O | B.NaCl溶液 | C.Na2CO3溶液 | D.Cu粉E.CuSO4粉末; |
你认为可行的是(填编号) 。
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为:,原子核外共有种不同能级的电子,氮原子核外电子云有种不同的伸展方向,有种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应(选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应(选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D.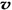 (N2)/
(N2)/ 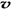 (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4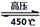 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是,每分解1mol高氯酸铵,转移的电子数目是。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是,每分解1mol高氯酸铵,转移的电子数目是。
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是(选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液B.Fe2O3 C.浓硫酸D.NaOHE.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/℃ |
1266 |
1534 |
183 |
试解释上表中氟化物熔点差异的原因:。SiF4分子的空间构型为,SiF4中Si—F键间的键角。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
该反应平衡常数的表达式K=;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L∙ min。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为。
有机物A可以通过不同的反应得到下列物质:
(1)A的结构简式是_________________
(2)A与_______________(填写化学式)反应生成D
(3)有机物C中共面的碳原子最多是_______________个
(4)芳香族化合物F是A的同分异构体,1molF可以和3mol NaOH发生中和反应;F苯环上的一氯代物只有一种,核磁共振氢谱显示F分子中有五种不同的氢原子。写出F两种可能的结构简式______________________。
下表是A、B、C、D四种有机物的有关信息;
| A |
B |
C |
D |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯E |
①由C、H、O三种元素组成; ②球棍模型为 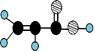 |
根据表中信息回答下列问题:
(1)写出与A互为同系物且比A多一个碳原子的有机物在一定条件下生成高分子化合物的化学反应方程式 _。
(2)与B具有相同的分子式,分子中每个碳原都以3个键长相等的单键分别跟其它碳原子相连,形成2个90°碳碳键角和1个60°的碳碳键角,该分子的键线式为_________。
(3)C与D反应能生成相对分子质量为100的酯E,该反应类型为 _;其化学反应方程式为: _。
请写出所有满足下列条件的C的同分异构体结构简式: _
Ⅰ.分子中不含支链并能使溴的四氯化碳溶液褪色
Ⅱ.能与NaHCO3溶液发生反应