下表是A、B、C、D四种有机物的有关信息;
| A |
B |
C |
D |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯E |
①由C、H、O三种元素组成; ②球棍模型为 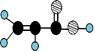 |
根据表中信息回答下列问题:
(1)写出与A互为同系物且比A多一个碳原子的有机物在一定条件下生成高分子化合物的化学反应方程式 _ 。
(2)与B具有相同的分子式,分子中每个碳原都以3个键长相等的单键分别跟其它碳原子相连,形成2个90°碳碳键角和1个60°的碳碳键角,该分子的键线式为_________。
(3)C与D反应能生成相对分子质量为100的酯E,该反应类型为 _ ;其化学反应方程式为: _ 。
请写出所有满足下列条件的C的同分异构体结构简式: _
Ⅰ.分子中不含支链并能使溴的四氯化碳溶液褪色
Ⅱ.能与NaHCO3溶液发生反应
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l)△H<0
N2O3(l)△H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向_______移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):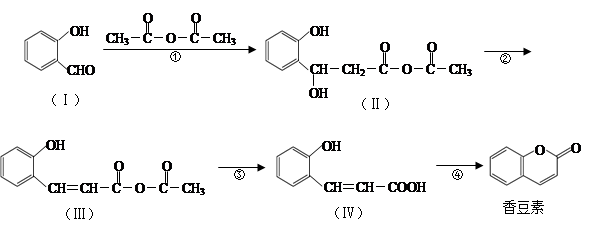
(1)香豆素的分子式为_______;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为_______________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,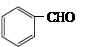 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
的结构简式为_____________。
(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。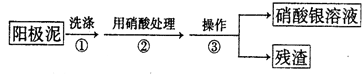
(1)操作③所需的仪器有:烧杯、。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式______。
(3)为了回收金,他们查阅了有关资料如下表:
| 编号 |
常温下反应 |
化学平衡常数 |
| 反应1 |
Au + 6HNO3  Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<10−5 |
| 反应2 |
Au3+ + Cl− [AuCl4]− [AuCl4]− |
>105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因:。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题: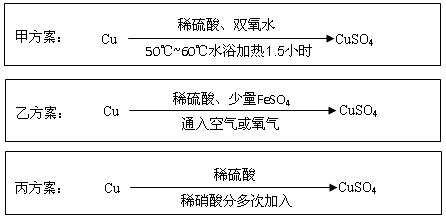
(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)="64" g/mol, M(CuSO4·5H2O) ="250" g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是;
②本实验CuSO4·5H2O的产率为。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的(填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)=。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: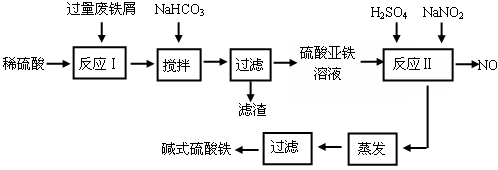
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在范围内,使溶液中的沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是,发生反应的离子方程式为。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: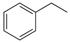 (g)
(g)
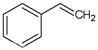 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式。该反应的化学平衡常数K=(用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K=(写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为。
N2O4(g)的平衡常数K=(写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂