已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: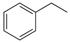 (g)
(g)
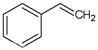 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。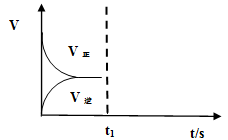
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。请根据上述信息回答:
请回答下列问题:
(1)H中含氧官能团的名称是 。B→I的反应类型为 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
(3)D和F反应生成X的化学方程式为 。
下列是有机化学中的反应类,回答下列问题
①由乙炔制氯乙烯 ②用甲苯制三硝基甲苯 ③乙烯使溴的四氯化碳溶液褪色
④甲苯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯 ⑥甲烷与氯气在光照的条件下反应
(1)写出①②⑤的反应方程式: 、 、 .
(2)①~⑥中属于取代反应的是(填序号下同) ;属于氧化反应的是 ;属于加成反应的是 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。海水中的“水”电池总反应可表示为:5MnO2 + 2Ag + 2NaCl=Na2Mn5O10 + 2AgCl
(1)写出负极电极反应式 。
(2)当生1 mol Na2Mn5O10时,转移电子的数目是 。
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
(3)写出A电极的名称 。
(4)写出电解时阳极的电极反应式 。
(5)已知电解排出液中n(OH-)/n(CO32-) =1,则起始时进入电解池中的原料配比n(KOH)/n[CO(NH2)2]是 。
有A、B、C、D、E、F六种主族元素,已知:
(a) A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等
(b) B、C原子核外电子层比A原子少一层,B的最高正价和负价的代数和等于零.C的气态氢化物化学式是H2C.
(c) D、E的阴离子都带一个单位的负电荷,D的阴离子电子层结构与氩原子相同.E元素没有对应的含氧酸.
(d) F与A属同一周期且是上述六种元素中原子半径最大元素。
(1)它们的元素中文名称为:A:_______ B:________ C:_______ D:_________ E:________F:__ __
(2)A、C、D、F四种元素的离子半径由大到小的顺序为 。
(3)B、C、D元素的气态氢化物的稳定性有强到弱的顺序为 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)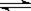 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。