(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
(5)25℃时,有等物质的量浓度的A. Na2CO3溶液、B. NaCN溶液、C.CH3COONa溶液,三溶液的pH由大到小的顺序为 。(用字母表示)
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
(5分)用化学用语填空。
⑴地壳中含量最高的金属元素的元素符号是;
⑵硫离子的离子符号;
⑶氯离子的离子结构示意图;
⑷H2SO3中硫元素的化合价为;
⑸硫酸铝的化学式。
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生(其中的S元素均为—2价)。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用溶液[或CuSO4溶液]吸收。(均写化学式)
(3)As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。酸性:HNO3H3AsO4(填“>”、“=”或“<”)。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。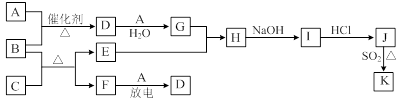
已知: A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为;F的电子式为。
(2)A与B生成D的反应在工业上是生产的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为。
(4)B和C反应的化学方程式为。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子
方程式。
黄铜矿( CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)、若冶炼铜的反应为:8 CuFeS2+21O2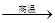 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
CuFeS2中Fe的化合价为+2,反应中被氧化的元素是___________(填元素符号)。
(2)、上述冶炼过程中产生大量SO2,下列处理方案合理的是___________(填代号)。
a.高空排放 b.用于制备硫酸
c.用浓硫酸吸收 d.用纯碱溶液吸收制Na2SO3
(3)、采用火法熔炼工艺生产铜的中间过程会发生Cu2O与Cu2S在高温下转化为Cu,放出SO2气体的反应。若Cu2O和Cu2S正好完全反应,Cu2O和Cu2S的物质的量之比为_____;Cu2S和HNO3有如下反应:3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO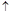 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
(4)、过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82-+2I—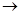 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
短周期元素W、X、Y和Z的原子序数依次增大。金属元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。
(1)W元素的原子核外共有________ 种不同运动状态的电子、_______ 种不同能量的电子。
(2)元素Z与元素X形成共价化合物XZ2是________(选填“极性”或“非极性”)分子,其电子式为 ________________。
(3)Y原子的最外层电子排布式为________________,Y元素最高价氧化物对应的水化物的电离方程式为 ________________________________________________。
(4)两种非金属元素中,非金属性较强的元素是_______(写元素符号),试写出一个能说明这一事实的化学方程式________________________________________________。