锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下: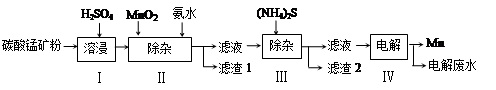
已知25℃,部分物质的溶度积常数如下:
| 物质 |
Mn(OH)2 |
Co(OH)2 |
Ni(OH)2 |
MnS |
CoS |
NiS |
| Ksp |
2.1×10-13 |
3.0×10-16 |
5.0×10-16 |
1.0×10-11 |
5.0×10-22 |
1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。
如图为一些常见无机物之间的转化关系,已知X是一种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
试回答下列问题:
(1)G的化学式为:______________;
(2)写出反应②的化学方程式__________;
(3)碱式盐X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸中HCl的物质的量之比为3 :8,则其与盐酸反应的化学方程式为____________。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有________________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是____________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_____________。
如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).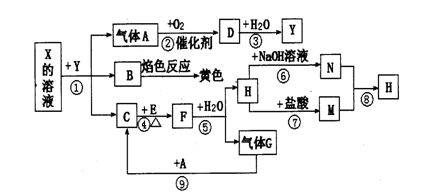
请回答下列问题:
(1)固体C的晶体类型是,F的化学式是。
(2)工业上要实现A—D D—Y的转化需要的设备分别是、。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是。
(4)反应⑧的离子方程式为。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为()。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |
(6) 分别向等体积等浓度的氢氧化钠溶液和盐酸中小心加入足量的E,同温同压下产生气体体积的大小关系是。(“前者大” “后者大” “相同”)
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: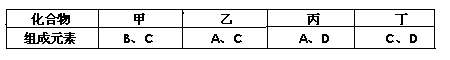
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)D元素形成的简单离子的结构示意图为,丙物质的化学式为,丁物质中阴离子与阳离子的个数之比为。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式。
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为。
(4)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则戊与己按物质的量3:4反应后溶液中溶质为。
(5)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下: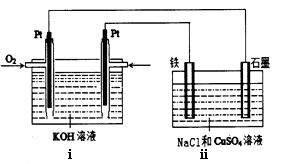
①写出ⅰ中通入该物质这一极的电极反应式。
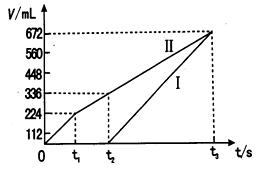
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的H+ 浓度约为。