某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/L H2SO 4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 /mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O /mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
② 该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应
是(填“吸热”或“放热”)反应。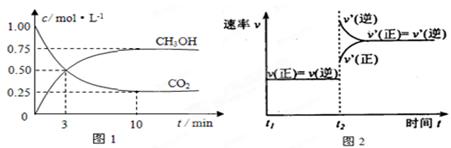
②500℃达平衡时,CH3OH的体积分数为。
(1)将反应2H2(g)+O2(g)=2H2O(1) △H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:。
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: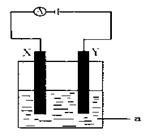
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为:。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为。
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=  ,请回答下列问题:
,请回答下列问题:
(1)该反应的化学方程式为___________________________________;若温度升高,K增大,则该反应是____反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是__________(填字母序号)。
| A.υ正(H2O)=υ逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗nmolH2的同时消耗nmolCO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的υ正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是_________________________、________________________。
某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是;阳极电极反应式为。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体mL
(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上(填“能”或“不能”)恢复原样。
发射卫星时可用肼(N2H4)为燃料和二氧化氮(NO2)作氧化剂,两者反应生成氮气和气态
水。已知:
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1①
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-543 kJ·mol-1② H2(g)+
H2(g)+ F2(g)===HF(g)ΔH=-269 kJ·mol-1③
F2(g)===HF(g)ΔH=-269 kJ·mol-1③
H2(g)+ O2(g)===H2O(g) ΔH=-242 kJ·mol-1④
O2(g)===H2O(g) ΔH=-242 kJ·mol-1④
(1)肼和二氧化氮反应的热化学方程式为______________________________________
(2)有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大,试写出肼和氟气反应的热化学方程式:____________________________________________________