“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式 ;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量 802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为 ;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
。
(一)元素X、Y、Z和W的质子数依次增大,都不超过20。X的原子半径是元素中最小的,Z元素的非金属性是元素中最强的,Y原子的最外层达到稳定结构所需的电子数恰好等于内层的电子数。W元素的原子结构中,K层、L层的电子数之和等于M层、N层的电子数之和。
请用文字和化学用语回答下列问题:
(1) X2Y分子形状是,是____分子(填“极性”或“非极性”)。
(2)用电子式表示化合物WZ2的形成过程。
XZ在X2Y中可以任意比例溶解,原因是。
(3)写出由这些元素组成的物质之间发生的一个置换反应。
(二)氮是地球上含量丰富的一种元素,氮及其化合物在工量农业生产、生活中有着重要作用。请回答下列问题:
右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。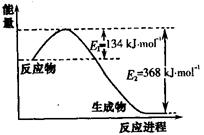
归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃ |
—218。4 |
113 |
450 |
|
| 单质沸点(℃) |
—183 |
444.6 |
685 |
1390 |
| 主要化合价 |
—2 |
—2,+4,+6 |
—2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)晶体硫属于晶体,硒的焙点T的范围可能是。
(2)碲的化合价可能有。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是(填化学式)。
(4)氢硒酸有较强的(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为。
(5)工业上Al2Te3可用来制各H2Te,完成下列化学方程式:
Al2Te3+()一A1(OH)3↓+H2Te↑
将a mol Na2O2与b mol NaHCO3混合共热到300℃,充分反应后(不与外界物质发生反应)得到固体和气体的成分,随着a与b的比值不同而不同,当a与b的比值为下列数值时,把得到的固体和气体的化学式填入下表:
| a/b |
固体物质的成分 |
气体物质的成分 |
| <1/2 |
||
| =1/2 |
||
| =1/1 |
||
| >1/1 |
现有甲、乙两瓶无色溶液,已知它们可能是NaOH溶液和AlCL3溶液。现做如下实验:
①440mL甲溶液与120mL乙溶液反应,产生1.56沉淀
②120mL甲溶液与440mL乙溶液反应,产生1.56沉淀
③120mL甲溶液与400mL乙溶液反应,产生3.12沉淀
通过必要的计算和推理判定:
甲溶液是_______,其浓度为____mol/L。乙溶液是_______其浓度为____mol/L
已知B、C为用途广泛的金属,H具有磁性氧化物,I是一种白色胶状沉淀,它们有如图所示的转化关系(部分产物未列出):
回答下列问题:
1.E和G的化学式分别为
2.写出反应的化学方程式:
①③
写出反应的离子方程式
②④