(一)元素X、Y、Z和W的质子数依次增大,都不超过20。X的原子半径是元素中最小的,Z元素的非金属性是元素中最强的,Y原子的最外层达到稳定结构所需的电子数恰好等于内层的电子数。W元素的原子结构中,K层、L层的电子数之和等于M层、N层的电子数之和。
请用文字和化学用语回答下列问题:
(1) X2Y分子形状是 ,是____ 分子(填“极性”或“非极性”)。
(2)用电子式表示化合物WZ2的形成过程 。
XZ在X2Y中可以任意比例溶解,原因是 。
(3)写出由这些元素组成的物质之间发生的一个置换反应 。
(二)氮是地球上含量丰富的一种元素,氮及其化合物在工量农业生产、生活中有着重要作用。请回答下列问题:
右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。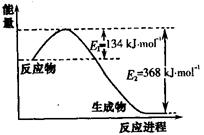
有一包固体混合物,可能含有的阴、阳离子分别是:
| 阳离子 |
K+、Ba2+、Ag+ |
| 阴离子 |
SO42-、CO32-、AlO2-、SO32- |
为了鉴定其中的离子,现进行如下实验。根据实验现象,填写下表:
(1)取该粉末,加水后得到无色溶液,用pH试纸测得溶液的pH=12。
| 排除的离子 |
排除的依据 |
(2)向溶液中滴加盐酸,先有沉淀生成,继续滴加沉淀消失,同时有无色无味气体逸出。
| 肯定存在的阴离子 |
判断依据 |
| 排除的离子 |
排除的依据 |
(3)尚待检验的离子及其检验方法
| 尚待检验的离子 |
检验的方法 |
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为____________。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_________________(填序号)。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA-, HA- H++A2-。
H++A2-。
①则Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是_______________________________(用离子方程式表示)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是:(填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
(10分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g) + B(g)  xC (g) + D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = 
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为数值是
(5)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
(6)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”)。
(8分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbLNaOH溶液,(题中a < b,b ≥ 8)。问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
.(9分)在0.l mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
| 改变条件 |
电离平衡移动方向 |
c(H+) |
c(CH3COO-) |
| 加水稀释 |
|||
| 加少量冰醋酸 |
|||
| 加入少量CH3COONa固体 |