某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 ;
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0. 2mol,则Fe电极的质量变化为 ;
(3)比较四个装置中Fe片被腐蚀的速率由快到慢的顺序是 (用A、B、C、D表示)。
(4分)下面列出了几组物质,请将物质的合适组号填写在空格上。互为同位素的是,互为同分异构体的是,互为同系物的是,互为同素异形体的是。
①金刚石与“足球烯”C60;②D2O与T2O;③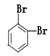 和
和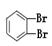
④CH4和CH3CH2CH3;⑤葡萄糖与果糖;⑥16O和18O
下列叙述正确的是
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C.常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D.16 g CH4与18 g NH4+所含质子数相等 |
(第一个空1分,其它每空2分,共9分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。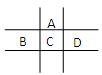
回答下列问题:
(1)B的元素名称为,D在周期表中的位置。
(2)A,C,D对应的离子半径由大到小顺序为,(用化学符号表示)
(3)D的单质与水反应的离子方程式为_。
(4)向D与E形成的化合物的水溶液中滴入过量烧碱溶液,用离子方程式表述
。
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极:;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
该反应的反应方程式可表示为,平衡时Y气体的转化率。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量。
(每空2分,共8分)某有机物完全燃烧生成标准状况下CO2的体积为4.48L,H2O的质量为5.4g,
(1)若此有机物的质量为3g,则此有机物的结构简式是______________________;
(2)若此有机物的质量为4.6g,则此有机物的结构简式是____________________;
(3)若此有机物的质量为6.2g,且此有机物1mol能和金属钠反应生成1molH2,则此有机物的结构简式是__________________;
(4) 等物质的量的此三种有机物完全燃烧,消耗氧气最多的是(名称)____________。