(4分)1836年,俄国籍瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应的热化学方程式,回答问题。
已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)===NH3(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH=-52.3 kJ/mol
⑤NH4Cl(s)===NH4Cl(aq) ΔH=?
则第⑤个热化学方程式中的反应热是 。
(9分)(1)在100℃时,PH=7呈性。
(2)碳酸钠溶液呈碱性的原因,用离子方程式表示:.
(3)氯化铝溶液呈酸性的原因,用离子方程式表示:
(4)写电离方程式NaHCO3
(5)(2分)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式:。
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物 质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_________________________________________________________。
在如图所示的三个容积相同的三个容器①、②、③进行如下的反应:3A(g)+B(g) 2C(g)△H<0
2C(g)△H<0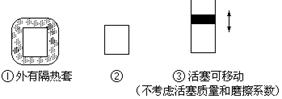
(1)若起始温度相同,分别向三个容器中充入3mol A和 1mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)
(2)若维持温度不变,起始时②中投入3mol A、1mol B; ③中投入3mol A、1mol B和2mol C,则达到平衡时,两容器中B的转化率②③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3molA和1molB,在③中投入amol A和bmol B及cmol C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
(本题6分)依据某氧化还原反应设计的原电池如图所示。
(1)该氧化还原反应的离子方程式为_________________________________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出铜片和银片洗净干燥后称重,总质量为67.6g,请计算:通过导线的电子的物质的量。(要求有计算过程)
(本题6分)Ⅰ.在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,发生如下反应: N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1。达到平衡时,体积为反应前的三分之二。求:
2NH3(g);ΔH=-92.4 kJ·mol-1。达到平衡时,体积为反应前的三分之二。求:
(1)达到平衡时,N2的转化率为____________。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:(1)__________(2)(填“>”“<”或“=”)。
Ⅱ.若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡。试比较平衡时NH3的浓度:Ⅰ____________Ⅱ(填“>”“<”或“=”)。