(14分)氮元素能形成多种多样的化合物。请回答:
(1)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ/mol (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L·mol-1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>”、“<”或“=”)。
(2)常温条件下,向100 mL 0.1mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如下图所示。试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的)。

①a点溶液的pH_________1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是____________;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
(9分)现有A、B、C三种均含同一种元素的无机物,它们之间的转化关系如下图所示(部分产物已略去)。
(1)若A、D为非金属单质:
①当M(A)>M(D)时,D为:;
②当M(D)>M(A)时,A为: ;
;
(2)若A为非金属单质,D为金属单质时,A为:;
(3)若D为非金属单质,A、B、C为卤化物时,写出①的化学反应方程式:。
(10分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: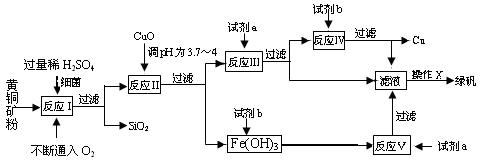

已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的p H如下表:
H如下表:
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = N a2Fe2O4+NH3+NaOH
a2Fe2O4+NH3+NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为,被还原物质是 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
写出下列反应的离子方程式
(1)小苏打溶液与 烧碱溶液反应:______________________________________
烧碱溶液反应:______________________________________
(2)在稀氨水中通入过量CO2气体:____________________________________
(3)MnO2与浓盐酸共热制取氯气:_____________________________________
(10) 在200 mL含Mg2+、Al3+、NH、H+、Cl-等离子的溶液中,逐滴加入5 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。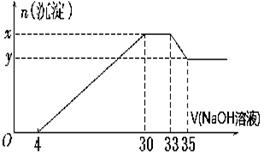
通过计算填写下列空白:
(1). x与y的差为
(2). 原溶液中c(Cl-)=
(3). 原溶液的pH=
(4). 原溶液中n(Mg2+)∶n(Al3+)=
(5). 所加氢氧化钠溶液体积大于33ml时,反应的离子方程式为.