为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = N a2Fe2O4+ NH3+ NaOH
a2Fe2O4+ NH3+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为 ,被还原物质是  。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 。
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。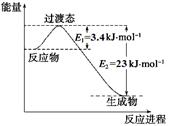
①写出该反应的热化学方程式:。
②能判断该反应达到化学平衡状态的依据是。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题: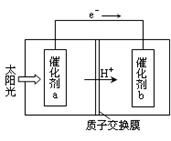
①该过程是将转化为。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示: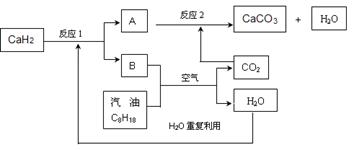
解决如下问题:
①写出CaH2的电子式。
②反应1中氧化剂与还原剂的物质的量之比是:。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式。
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: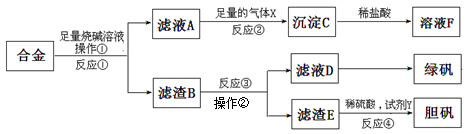
请回答:
(1)绿矾的化学式为。
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积L。
工业合成氨与制备硝酸一般可连续生产,流程如下: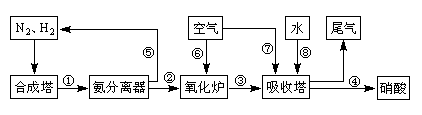
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=(填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1300℃(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在左右。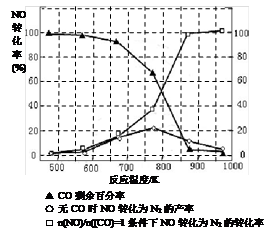
有增长碳链是有机合成中非常重要的反应。例如:
反应①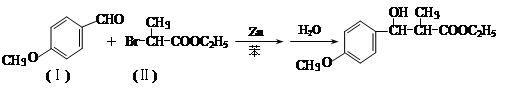
用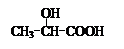 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):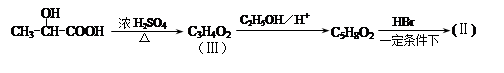
(1)(Ⅰ)的分子式为;1mol该物质完全燃烧需要消耗mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为。
(Ⅲ)的结构简式为;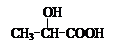 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为,该反应的反应类型是。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为,该反应的反应类型是。
(4)对二氯苯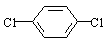 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为。
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。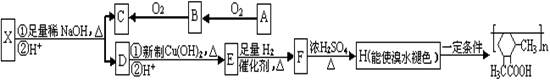
已知:①在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应:
CH3CH(OH)2→CH3CHO +H2O
回答下列问题:
(1)C的结构简式为 ;F→H的反应类型是 。
(2)E不具有的化学性质 (选填序号)
a、取代反应b、消去反应
c、氧化反应 d、1molE最多能与2mol NaHCO3反应
(3)写出下列反应的化学方程式:
① X与足量稀NaOH溶液共热的化学方程式: ;
② A→B的化学方程式: ;
(4)同时符合下列条件的E的同分异构体共有 种,
a、苯环上的一氯代物有两种 b、不能发生水解反应 c、遇FeCl3溶液不显色
d、1molE最多能分别与1molNaOH和2molNa反应
其中核磁共振氢谱为六组峰,且峰面积比为3:2:2:1:1:1的一种结构简式为 。