现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________。
A. c(H+) B. c(H+)/ c(CH3COOH)
C. c(H+)·c(OH-) D. c(OH-)/ c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_____pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K1 |
1.8×10-5 |
4.3×10-7 |
3.0×10-8 |
| K2 |
—— |
5.6×10-11 |
—— |
下列四种离子结合H+能力最强的是______________。
A. HCO3- B. CO32- C. ClO- D. CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):_________________;
HClO+Na2CO3(少量):___________________。
请利用下列装置及试剂组装一套装置。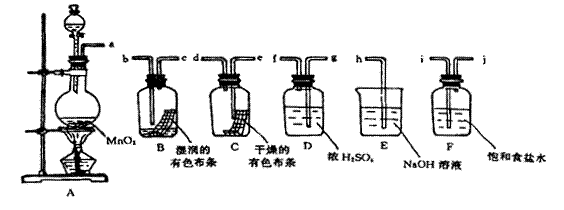
其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接____ _____ 接 ___________接_____________接______ _______ 接h 。
(2)烧 瓶
瓶 中发生反应的化学方程式是。
中发生反应的化学方程式是。
(3)E装置的作用是,F装置的作用是。
(4)C瓶中的现象是,B瓶中的现象是。以上事实说明起漂白作 用的物质是。
用的物质是。
(1)某实验需要用1.0mol·L-1 NaOH 溶液450mL。配制该溶液所需要的玻璃仪器有;
(2)配制实验操作步骤有:a.在天平上称量g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入一定容积容量瓶中。c.继续向容量瓶中加水至距刻度线1cm~2cm处,改用胶头滴管加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀。e.将容量瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为 。
。
②该配制过程中两次用到玻璃棒,其作用分别是、 。
。
③定容时,若俯视凹液面,会使结果(填“偏高”、“偏低”或“无影响”)
④若没有进行d步操作,会使结果(填“偏高”、“偏低”或“无影响”)
⑤在进行b步操作时,不慎有液体溅出,下列处理措施正确的是()
| A.继续进行实验 | B.添加部分NaOH溶液 |
| C.倒掉溶液,重新配制 | D.倒掉溶液,洗净容量瓶后重新配制 |
A、B、C、D、E五种物质的转化关系如下图所示: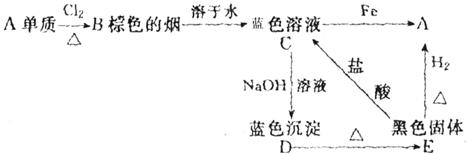
(1)确定A、B、C、D、E各为什么物质:
A、_________, B、__
B、__ _______,C、_________,D、_________,E、_________。
_______,C、_________,D、_________,E、_________。
(2)写出下列各步反应的化学方程式:
C→D:_____________________________________________;
E→C:_____________________________________________;
C→A:_____________________________________________。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的 某一种,阴离子分别可能是NO3-、SO
某一种,阴离子分别可能是NO3-、SO 42-、Cl-、CO32-中的某一种。
42-、Cl-、CO32-中的某一种。
( 1)若把四种
1)若把四种 盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1)(2)实验事实可推断它们的化学式为:
A. _________;B. _________;C. _________;D. ___________。
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出 下列物质的化学式:C,D,E。
下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
①A和水生成E:。
②B和D生成C: 。
。
③Cl2与E的水溶液:。