(10分) (1)在一定条件下,容积为 10 L密闭容器中发生反应:
CH4(g)+H2O(g) 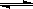 CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
将1.0 mol CH4和2.0 mol H2O(g)通入该密闭容器 3 s时有0.1 mol CO生成,则3 s内该反应的平均速率v(H2)=。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 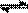 CH3OH(g)。CO的转化率与温度、压强的关系如图。
CH3OH(g)。CO的转化率与温度、压强的关系如图。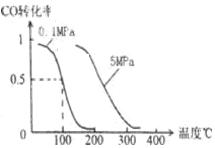
①该反应是反应(填“放热”或“吸热”)。
②150℃时该反应的平衡常数KV2/a2(填“=”“<”或“>”)。
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,和b mol CH3OH(g),则达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”或“无法确定”),平衡常数(填“增大”、“减小”或“不变”)。
(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式: ▲。
(2)白色固体转化成黑色固体的原因是: ▲。
如图所示,600K时,在容积可变的透明容器内,反应2HI(气) I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
某酯A的化学式为C9H10O2,且A分子中只含有1个苯环,苯环上只有一个取代基。现测出A的1H-NMR谱图有5个峰,其面积之比为1︰2︰2︰2︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图: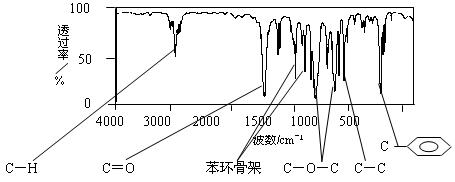
试回答下列问题。
(1)A的结构简式可为C6H5COOCH2CH3 C6H5CH2OOCCH3、。
(2)A的芳香类同分异构体有多种,请按要求写出其中不含甲基且属于芳香酸的B的结构简式:。
(3)已知C是A的同分异构体,分子中不含甲基,且遇FeCl3溶液显紫色,苯环上只有两个对位取代基的芳香醛,且有如下转化关系。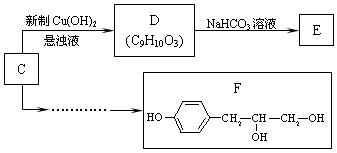
①写出D→E的化学方程式。
②请用合成反应流程图表示出由C合成F的最合理的合成方案(注明反应条件)。
提示:合成反应流程图表示方法示例如下: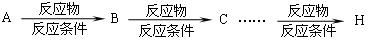
有机化合物中当某一碳原子同时连有两个—OH是一种不稳定结构,会自动转化为稳定结构,例如:
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生下列反应:
试回答下列问题:
(1)X为(填元素符号);写出E的结构简式:。。
(2)写出反应①的反应方程式并指明反应类型
(3)写出由A→C的化学反应方程式:。
(4)写出与E互为同分异构体,且同时符合下列四个条件的有机物的结构简式:①含酯基;②含酚羟基;③不能发生银镜反应;④苯环上的一氯取代物只有2种。
。