碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2 |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol 电子,锌的质量理论上减小6.5g |
下列说法正确的是
| A. | 按系统命名法,化合物 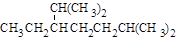 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 |
| C. | 化合物 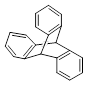 是苯的同系物 是苯的同系物 |
| D. | 三硝酸甘油酯的分子式为 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是()
| A. | 在阴极式,发生的电极反应为:
 ↑
↑ |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区
浓度增大,使平衡
+2
 +
向右移动
+
向右移动 |
| C. | 该制备过程总反应的化学方程式为:

|
| D. | 测定阳极液中 和 的含量,若 与 的物质的量之比为 ,则此时铬酸钾的转化率为 |
、 、 是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与 的核外电子数相等, 、 分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A. | 原子半径: |
| B. | 与 形成化合物的沸点高于 的同族元素与 形成化合物的沸点 |
| C. | 与水发生氧化还原反应时, 只作氧化剂 |
| D. | 、 和 等3种化合物中,阳离子与阴离子个数比均为1︰2 |
下列说法正确的是
| A. | 在"镀锌铁皮的镀层厚度的测定"实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全。 |
| B. | 在"火柴头中氯元素的检验"实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在。 |
| C. | 在"硫酸亚铁铵的制备"实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。 |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
下列说法不正确的是()
| A. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学 |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C. | 通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. |