氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
| A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)的 |
| B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应 |
| C.Mg可由电解熔融MgO制取,Na也可由电解熔融NaCl制取 |
| D.铝热法还原铁的反应中,放出的热量能使铁熔化 |
爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH-
③ 放电时,电解质溶液中的阴离子向负极方向移动
④ 放电时,负极上的电极反应式为:Fe+2H2O-2e-=Fe(OH)2+2H+
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
| A.③ | B.③④ | C.④ | D.①②⑤ |
下列图像能正确地表达可逆反应3A(g)+B(g) 2C(g)(△H<0)的是
2C(g)(△H<0)的是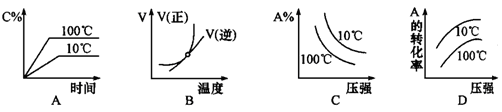
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是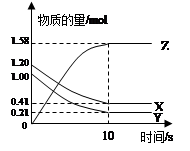
A.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
| D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
下列说法正确的是
| A.蓄电池充电时其负极应与外电源的的正极相连接 |
| B.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同 |
C.已知:H2(g)+I2(g)  2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量 |
| D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1 |
在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.化学计量数关系:a>b |