在一密闭容器中,反应 aA(g)  bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
| A.平衡向正反应方向移动 | B.a>(b+c) |
| C.物质B的质量分数增大 | D.以上判断都错误 |
已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:
2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是
| A.加入适量稀盐酸 | B.加入适量稀硝酸 |
| C.加入适量烧碱固体 | D.加水稀释 |
金属卤化物跟卤素化合可生成多卤化物,如:KI+I2 KI3,有关KI3的叙述中不正确的是
KI3,有关KI3的叙述中不正确的是
| A.I2在KI溶液中溶解度增大是由于生成I3-离子 |
B.I3-在溶液中存在下列平衡I3- I2+I- I2+I- |
| C.KI3溶液遇淀粉不变蓝色 |
| D.将Cl2通入KI3溶液中,I3-浓度减小 |
常温下,下列溶液中c(H+)最小的是
| A.pH=4的H2SO4溶液 | B.pH=3的CH3COOH溶液 |
| C.c(OH-)=1×10-11mol·L-1 | D.c(H+)=1×10-3mol·L-1 |
COCl2(g)  CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施①升温 ②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施①升温 ②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
已知:2X+Y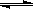 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |