某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。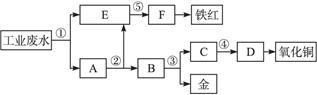
填写下面空白。
(1)图中标号处需加入的相应物质分别是①____________、②___________、③___________、④___________、⑤___________;
(2)写出①处发生反应的离子方程式___________;写出③处发生反应的化学方程式:______________________;
(3)铁红的化学式为___________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红__________________;氧化铜________________________。
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液,滴加稀硫酸,有白色沉淀生成。
④另取少量②的溶液,滴加AgNO3溶液,有白色沉淀生成。
请回答:
(1)根据上述实验现象,判断原白色粉末的组成成分是___________(填写名称)。
(2)写出①—④中涉及的化学方程式:
①______________________________
②_____________________________
③______________________________
④_____________________________
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。为了除去杂质在实验室中可将粗盐溶于水然后进行下列操作:(1)过滤;(2)加入过量的氢氧化钠溶液;(3)加入适量的盐酸;(4)加过量Na2CO3溶液;(5)加过量的BaCl2溶液。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)以上操作的正确顺序是( )
| A.(5)(4)(2)(1)(3) | B.(1)(2)(3)(4)(5) |
| C.(5)(4)(3)(2)(1) | D.(1)(5)(4)(2)(3) |
(2)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为___________。
(3)如何运用最简的方法检验溶液中有无SO42―离子?______________________________。
如果有,应该如何除去SO42―离子?
___________________________________________。
(4)在粗盐经过溶解等步骤后,在过滤前的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是
______________________________________________。
(5)将经过操作(4)后的溶液过滤。请问这一操作能除掉哪些杂质?
(6)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:________________________________________。过滤时:________________________________________。蒸发时:________________________________________。
用18 mol / L的硫酸溶液配制500 mL 1 mol / L的硫酸溶液,有下列操作步骤:
(1)将溶解后的硫酸溶液立即沿玻璃棒转入容量瓶中;
(2)将量得浓硫酸倒入烧杯中,加水溶解,然后用蒸馏水洗涤量筒2~3次倒入烧杯中;
(3)盖上瓶塞,轻轻摇匀即配制完毕。
(4)洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中,加水至离刻度1~2 cm处,改用胶头滴管加水至刻度线;
(5)用量筒量取27.78 mL的浓硫酸。
先将以上步骤按实际操作的先后顺序排列,________________指出操作中所有的错误和不妥之处。
电制法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42―杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是____________,所用玻璃仪器是________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________溶液。
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式________________。
(1)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号):________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.往容量瓶中转移溶液时应用玻璃棒引流