用18 mol / L的硫酸溶液配制500 mL 1 mol / L的硫酸溶液,有下列操作步骤:
(1)将溶解后的硫酸溶液立即沿玻璃棒转入容量瓶中;
(2)将量得浓硫酸倒入烧杯中,加水溶解,然后用蒸馏水洗涤量筒2~3次倒入烧杯中;
(3)盖上瓶塞,轻轻摇匀即配制完毕。
(4)洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中,加水至离刻度1~2 cm处,改用胶头滴管加水至刻度线;
(5)用量筒量取27.78 mL的浓硫酸。
先将以上步骤按实际操作的先后顺序排列,________________指出操作中所有的错误和不妥之处。
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。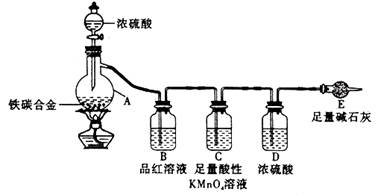
Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:_______。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4 Fe2(SO4)3 + 3SO2↑ +6H2O
Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________ (写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。
(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。
(2)配制氯化钠溶液时,容量瓶中有少量水。。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
| 实验编号 |
盐酸体积( mL ) |
标准NaOH溶液的体积(mL) |
| 1 |
20.00 |
18.20 |
| 2 |
17.10 |
|
| 3 |
16.90 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_______________。
A.滴定管在装标准NaOH溶液前未润洗
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干
E.达到滴定终点时,俯视溶液凹液面最低点读数
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
G.滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸溶液的物质的量浓度为___________(结果保留三位小数)。
实验室常用加热铵盐和碱的固体混合物的方法制取氨气。
根据下图回答问题: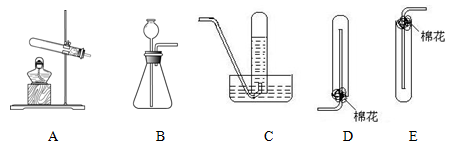
(1)实验室制取氨气的发生装置为(填序号),该反应的化学方程式为。
(2)下列气体可以用与氨气相同的收集装置收集的是(填序号)。
A. H2 B. CO2
氯气是一种化学性质活泼的气体。
⑴氯气是一种具有气味的气体,密度比空气的(填“大”或“小”),若采用图中装置收集氯气,则氯气应由管(填“A”或“B”)通入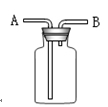
⑵氯气与NaOH溶液反应的化学方程式为,该反应可用于工业上制取漂白液,其有效成分是。
(11分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。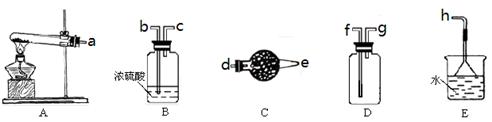
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
用A装置制取NH3的化学反应方程式为
(2)用下图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用(选填字母编号);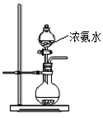
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E、烧碱 |
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是,试写出制纳米级碳酸钙的化学方程式;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级