在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的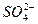 离子浓度逐渐增大 离子浓度逐渐增大 |
B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
| A.平衡常数:K(a)>K(c) K(b)=K(d) |
| B.正反应速率:v(a)>v(c) v(b)>v(d) |
| C.平均摩尔质量:M(a)<M(c) M(b)>M(d) |
| D.平衡时a点一定有n(CO):n(H2)=1:2 |
下述实验能达到顶期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 |
证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B |
向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) |
滴定其中NaOH含量 |
| C |
两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 |
证明稀释前c(X)=10c(Y) |
| D |
测定等物质的量浓度的HF与HCl溶液的pH,后者较小 |
证明非金属性Cl>F |
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是
A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
下列叙述正确的是
| A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2 |
| B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大 |
| C.在饱和氨水中加入同浓度的氨水,平衡正向移动 |
| D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7 |
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |