为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是
| A.NaOH | B.MgO | C.氨水 | D.铁粉 |
下列化学用语表示正确的是
A.氮原子结构示意图: |
| B.乙烯的结构式:CH2CH2 |
| C.含有10个中子的氧原子:1018O |
D.苯的结构简式: |
下列说法正确的是
| A.难失电子的原子,得电子的能力一定强 |
| B.最外层电子数大于4的,在化学反应中一般易得电子 |
| C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大 |
| D.任何原子的原子核都是由质子和中子构成的 |
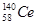 是地壳中含量最高的稀土金属元素。下列关于
是地壳中含量最高的稀土金属元素。下列关于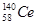 的说法正确的是
的说法正确的是
| A.质量数为198 | B.中子数为140 |
| C.质子数为82 | D.核外电子数为58 |
45mL某气体,可能含有CO2、O2、NH3将其通过浓硫酸,气体体积无变化,通过足量的Na2O2后,体积变为30mL,则该气体的组成为
| A.CO2为30mL,为15mL | B.NH3为30mL,O2为15mL |
| C.CO2为15mL,O2为30mL | D.CO2为30mL,O2为15mL |
向三份同浓度的25mL盐酸中分别加入质量不等的NaHCO3、KHCO3的混合物,测得产生气体的体积如下表所示(不考虑气体溶解)
| 编号 |
1 |
2 |
3 |
| m(混合物)/g |
4.6 |
7.2 |
7.9 |
| V(CO2)(标准状况)/L |
1.12 |
1.68 |
1.68 |
下列分析推理正确的是
A.根据实验1中的数据可以计算出盐酸的浓度
B.混合物中NaHCO3的质量分数约为45.7%
C.根据第2、3组数据可以分析出第2组中的混合物完全反应
D.盐酸的物质的量浓度为1.5mol.L-1