A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离予相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。下列说法正确( )
A.B的最高价氧化物对应水化物化学性质稳定
B.C、D、E、F原子半径由大到小的顺序为C>D>E>F
C.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
D.元素D、E、F的单质晶体属于同种类型的晶体
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g) 2NH3(g) ⊿H=-92.4kJ·mol-1]
2NH3(g) ⊿H=-92.4kJ·mol-1]
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3<1
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,t表示温度,n表示物质的量):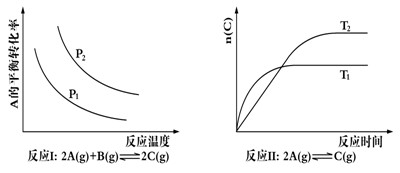
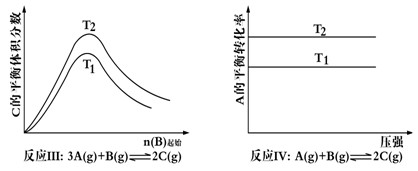
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ△H> 0,P2>P1 | B.反应Ⅱ△H<0,T1>T2 |
| C.反应Ⅲ△H> 0,T2>T1;或△H<0,T2<T1 | D.反应Ⅳ△H<0,T2>T1 |
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是
| A.阴极自始至终只析出氢气 | B.阳极先析出Cl2,后析出O2 |
| C.电解的最后阶段为电解水 | D.溶液pH不断增大,最后pH=7 |
下列说法正确的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的△H>0,△S>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是
| A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY |
| B.若a>b且c(X-)=c(Y-),则酸性HX<HY |
| C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY |
| D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则a=b=0.1mol/L |