某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,则此气态烃可能是( )
A.CH≡≡CH B.CH2==CH2
C.CH≡≡C—CH3 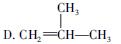
下列离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2A(OH)3↓+ CO32- |
| C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH- |
下列物质性质与应用对应关系正确的是
| A.钠和钾的合金具有导电性,可用于快中子反应堆热交换剂 |
| B.明矾溶于水能产生Al(OH)3胶体,可用作净水剂 |
| C.甲醛能使蛋白质变性,可用于食品防腐剂 |
| D.水玻璃易溶于水,可用于生产黏合剂和防火剂 |
【原创】常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使酚酞变红色的溶液:Na+、Mg2+、NO3-、SO42- |
| B.pH=1的溶液:Na+、K+、NO3-、ClO- |
| C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、SO42- |
| D.0.1 mol·L-1 Na2CO3溶液: Na+、Ba2+、Cl-、OH- |
下列有关化学用语表示正确的是
A.氢氧化钠的电子式: |
B.Cl-的结构示意图: |
C.2-丁醇的结构简式: |
| D.碳酸的电离方程式:H2CO3=2H++CO32- |
2014年12月科学家发现了迄今为止最轻的冰——“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构。下列有关叙述中不正确的是
| A.冰的密度比液态水小 |
| B.冰与干冰由不同分子构成 |
| C.“冰十六”可以包合气体分子 |
| D.液态水转变成“冰十六”是化学变化 |