2014年12月科学家发现了迄今为止最轻的冰——“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构。下列有关叙述中不正确的是
| A.冰的密度比液态水小 |
| B.冰与干冰由不同分子构成 |
| C.“冰十六”可以包合气体分子 |
| D.液态水转变成“冰十六”是化学变化 |
下列说法正确的是
| A.金属元素不可能形成含氧酸根离子 |
| B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 |
| C.金属与非金属元素分界线附近的元素是过渡元素 |
| D.形成化合物种类最多的元素在IVA族 |
下列关于常见有机化合物的说法中正确的是
| A.分子式为C4H10的物质具有三种分子结构 |
| B.甲烷、苯、乙酸在一定条件下都能发生取代反应 |
| C.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
| D.用氢氧化钠溶液与乙酸乙酯充分混合并振荡,以除去其中的乙酸 |
下列说法正确的是
| A.相同物质的量的O2和O3,体积相同 |
| B.离子化合物一定含有离子键,可能含有共价键 |
| C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快 |
化学在生产和日常生活中有着重要的应用。下列叙述不正确的是
| A.晶体硅是光导纤维、芯片的主要成分 |
| B.在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C.工业上用石灰对煤燃烧后的烟气进行脱硫,并能制取石膏 |
| D.氯气是合成农药、染料和药品的重要原料 |
在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):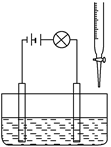
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是。
(2)有白色沉淀生成,说明,
红色变浅说明。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______ mL,离子反应方程式为。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为。