下列过程属于固氮的是()
| A.NH3→NO | B.NO→NO2 | C.N2→NO | D.N2→NH3 |
下面是实验室制取氨气的装置和选用的试剂,其中错误的是()
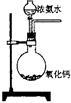


A B C D
都能用下图装置进行喷泉实验的一组气体是()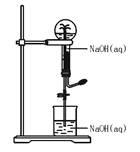
| A.HCl和CO2 | B.NH3和CO |
| C.SO2和CO2 | D.NO2和NO |
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成分是
| A.CH4和NH3 |
| B.HCl、H2和CO |
| C.HCl和CO |
| D.HCl、CO和CO2 |
把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( ).
| A.2 mol | B.3 mol | C.4 mol | D.5mol |