写出下列制取氯气的化学反应方程式:
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学反应方程式为_____________________。
(2)高锰酸钾(KMnO4)是常用的氧化剂,在酸性条件下, 被还原成Mn2+。试写出用高锰酸钾跟浓盐酸在室温下制取氯气的化学反应方程式:____________________________。
被还原成Mn2+。试写出用高锰酸钾跟浓盐酸在室温下制取氯气的化学反应方程式:____________________________。
(3)历史上曾用“地康法”制取氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中氧气跟氯化氢反应制取氯气,化学反应方程式为__________________________。
从氯元素化合价的变化来看,以上三种方法的共同点是____________,比较以上三个反应,可得出三种氧化剂的氧化能力由强到弱的顺序为____________。
溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中。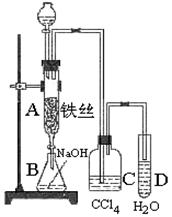
(1)写出A中反应的化学方程式
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,C中盛放CCl4的作用是;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入溶液,现象是,则能证明;或者向试管D中加入溶液,现象是
已知非金 属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是。
,烧瓶中加入的试剂是。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用。
(3)装置B中盛放的试剂是(选填下列所给试剂的代码),
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
化学反应方程式是。
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
(12分)某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹).请对其方案进行完善或评价;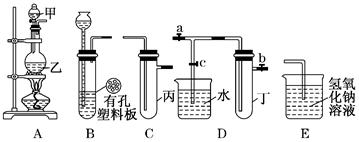
(1)实验室将B、C、E相连后,以、(填写名称)为原料可制取Cl2,为接下来研究氯气的化学性质做准备。
(2) 利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验 序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气 泡产生 |
氯气与水反应的产物具有酸性 |
请你评价:实验Ⅰ后,推出相应结论是否合理? ________________。若不合理,请说明理由(若合理,则无需填写下行):___________________________________________.
实验Ⅱ推出相应的结论是否合理? ________________若不合理,请说明理由(若合理,无需填写下行):____________________________________________________.
(3)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱。有关反应的离子方程式为:____________________________________,
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为___________________________
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的可能的操作是。
用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
| 熔点 |
沸点 |
|
| PCl3 |
-112℃ |
75℃ |
| PCl5 |
148℃ |
200℃ |

请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是。
(2)为得到氯气,若B中加入MnO2,则A中应加入,反应的化学方程式为___________________________________ 。
(3)若发现C中气泡产生过猛,需要进行的操作或对装置进行的改进是。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是;从PCl3和PCl5的混合物中分离出PCl3的方法是(选填序号)。
a.蒸馏 b.过滤 c.分液 d.升华
(5)生成的PCl3在G中收集 ,则F中盛有,作用是______________________。
,则F中盛有,作用是______________________。
(6)C、D、H所盛的试剂分别是(选填序号):C; D; H。
a.饱和食盐水 b.浓硫酸 c.无水氯化钙 d.碱石灰
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是。
高中教材中介绍:品红溶液能被SO2漂白。某研究性学习小组的同学决定通过实验探究:SO2的漂白作用到底是SO2本身还是SO2与水作用的产物导致的。他们查阅资料知:品红除了可以溶于水外,还可以溶于酒精中,也能形成红色溶液,且SO2不能与酒精反应。经过研究,该小组设计了如图所示的装置,请根据实验目的回答以下问题。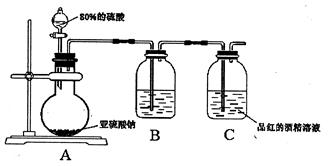
(1)上述装置A中发生的化学反应方程式为:。
(2)制取SO2时,一般选择80%左右的硫酸,而不宜选择10%的硫酸,原因是。
(3)装置B中应该装入的药品为。
(4)该装置有一个明显的不足之处是。
(5)按照完善后的装置完成实验,实验中控制SO2以大约每分钟200个气泡的速率通过品红的酒精溶液,20分钟后溶液仍不褪色。由此可知,SO2的漂白作用是导致的。