实验室制备1,2-二溴乙烷的反应原理如下: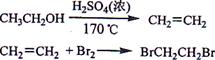
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: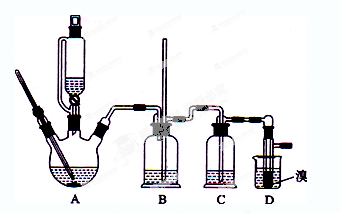
有关数据列表如下:
| |
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
草酸亚铁晶体的化学式为FeC2O4.2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4.2H2O FeO+CO2+CO+2H2O
FeO+CO2+CO+2H2O
(1)请你用下图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4·2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去)。在答题卡上填写下表(可以不用填满,也可以补充)。
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
草酸亚铁晶体 |
加热草酸亚铁晶体得到气体产物 |
| D |
NaOH溶液 |
|
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是 。
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是 。
某校化学小组的同学开展了一系列的化学实验活动。
(1)甲同学用图1所示装置,测量锌与硫酸反应速率;把2g锌粒放入锥形瓶内,通过分液漏斗加入1mol·L—1稀硫酸40mL收集10mL气体,通过记录 得到反应速率为XmL·min—1。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于 、 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是 ;
③仪器甲、乙接口的连接方式如下:A连接 ,B连接 ,C连接 (填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是 。如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
①按如图组装仪器, ;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)补全步骤①的操作 .
(2)装置C的作用为 .
(3)测得反应后装置B增重1.35g,则铁矿石中氧的质量百分含量为 .
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 .
(2)下列有关步骤⑥的操作中说法正确的是 .
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(3)若滴定过程中消耗0.5000mol•L﹣1的KI溶液22.50mL,则铁矿石中铁的质量百分含量为 .
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 .
甲、乙两位同学分别用不同的方法配制100 mL、3.6 mo1/L的稀硫酸。
(1)若采用18 mo1/L的浓硫酸配制溶液,需要用到浓硫酸的体积为________。
(2)甲同学:量取浓硫酸小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是_______________________。
②洗涤操作中,将洗涤烧杯后的洗涤液也注入容量瓶中,其目的是_________________。
③定容的正确操作是 ________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓硫酸 |
| D.重新配制 |
(3)乙同学:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,最后搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处:_________。
如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合,及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。
① A与____组合,用于____________________,
② B与____组合,用于____________________,
③ B与____组合,用于____________________,
④ D与____组合,用于____________________。