下列物质有固定熔点的是
| A.钢化玻璃 |
| B.过磷酸钙 |
| C.消石灰 |
| D.水玻璃 |
下列各表述与示意图一致的是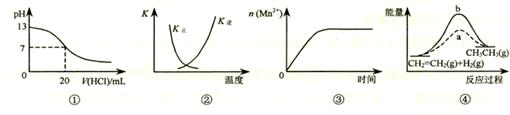
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
下列叙述正确的是
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b |
| B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13,则此溶液一定呈酸性 |
| C.25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7 |
| D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法错误的是
A.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在冰醋酸中硝酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为:H2SO4===2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
某温度下,反应2NO2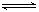 N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有
N2O4;△H<O,在密闭容器中达到平衡。平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有
| A.保持容器容积和温度不变,向容器内补充了NO2 |
| B.保持容器压强和温度不变,向容器内补充了N2O4 |
| C.保持容器容积和温度不变,向容器内补充了N2 |
| D.保持容器的容积不变,升高了温度 |
甲酸和乙酸都是弱酸,当它们的浓度均为0.1mol•L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种不同浓度的甲酸a和b,以及0.10 mol•L-1的乙酸。经测定它们的pH从小到大依次为a、乙酸、b。由此可知
| A.a的浓度必小于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
| C.b的浓度必小于乙酸的浓度 | D.b的浓度必大于乙酸的浓度 |