完成下列反应的离子方程式
①工业上用NaOH溶液吸收制硝酸的尾气
②过量的硫化氢通入氢氧化钠溶液中
③实验室用三氯化铁溶液制备氢氧化铁胶体
④用惰性电极电解MgCl2溶液
⑤过量的铁投入稀硝酸中
⑥硫化氢使湿润的醋酸铅试纸变黑
⑦NH4HCO3与NaOH溶液共热
由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃ 下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为()
A.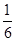 |
B.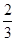 |
C. |
D. |
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4,M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示:有关上述转化过程的下列叙述正确的是( )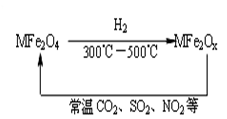
| A.MFe2O4表现了还原性 |
| B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 |
| D.SO2和NO2发生了分解反应 |
离子M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X- +3S2- +cH+=2M3+ +eSœ +fH2O,则M2O7X-中M的化合价为()
| A.+4 | B.+5 | C.+6 | D.+7 |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积为3:2:1时,三种溶液中Cl﹣的物质的量之比为()
| A.1:1:1 | B.1:2:3 | C.3:2:1 | D.3:4:3 |
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:Cl2+2NaOH=NaCl+NaClO+H2O ,3Cl2+6NaOH=5NaCl+ NaClO3 +3H2O),经测定ClO﹣与ClO3﹣的物质的量之比为1:2,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为] ( )
| A.21:5 | B.11:3 | C.3:1 | D.4:1 |