NA表示阿伏加德罗常数,下列叙述正确的是
| A.1mol过氧化氢分子中共用电子对数为3NA |
| B.常温常压下,22.4L的D2、H2组成的气体分子数为NA |
| C.标准状况下,22.4LSO3中含有的氧原子数为3NA |
| D.1molNa2O2与CO2充分反应转移的电子数为2NA |
下列化学反应基本类型中一定发生电子转移的是 ()
| A.化合反应 | B.分解反应 | C.复分解反应 | D.置换反应 |
下列物质中属于电解质的是()
| A.氯化氢 | B.酒精 | C.三氧化硫 | D.铁 |
下列叙述正确的是( )。
| A.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
| B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍 |
| D.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)都是定值。 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )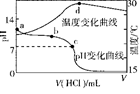
| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是()
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)