制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。 阴极:2H3O++2e-→H2↑+2H2O
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O—→H2SO4+H2SO5第二步水解 H2SO5+H2O—→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( )
| A.0.5mol | B.1mol | C.1.5mol | D.2mol |
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是 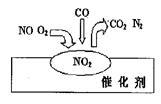
| A.NO2是该过程的最终产物 |
| B.NO和O2必须在催化剂表面才能反应 |
| C.汽车尾气的主要污染成分是CO2和NO |
D.该催化转化的总反应方程式为:2NO +O2 +4CO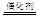 4CO2+N2 4CO2+N2 |
下列反应的离子方程式正确的是
| A.澄清的石灰水跟盐酸反应:2H++Ca(OH)2="=" Ca2++2H2O |
| B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑ |
| C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O |
| D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑ |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4LCO2与CO的混合气体含NA个分子 |
| B.标准状况下,22.4LSO3含有NA个分子 |
| C.1molNa2O2与足量CO2反应转移的电子数为2NA |
| D.常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
对反应2Al+2NaOH+2H2O="=" 2NaAlO2+3H2↑的说法正确的是
| A.氧化剂是NaOH | B.生成3mol H2时转移了6mol电子 |
| C.反应中的Al被还原 | D.1molAl失电子,有2molH2O中的氢得电子 |
能选用右图装置正确完成的实验是
| A.用铅粒与稀硫酸制取并收集H2 |
| B.用少量MnO2和H2O2制取并收集O2 |
| C.用生石灰和浓氨水制取并收集NH3 |
| D.用浓硫酸和浓盐酸制取并收集HCl |