右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
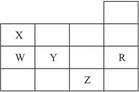
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
将30ml 0.5mol/L Na2SO4溶液加水稀释到500ml,稀释后溶液中SO42-的物质的量浓度为()
| A.0.3mol/L | B.0.03mol/L | C.0.05mol/L | D.0.04mol/L |
下列各组物质中,所含分子数相同的是()
| A.10gH2和10g O2 | B.5.6LN2和11gCO2 |
| C.9gH2O和0.5mol H2 | D.224ml H2(标况)和0.1mol N2 |
如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是()
| A.过滤 | B.分液 | C.蒸发 | D.蒸馏 |
在100 mL某混合溶液中,c(HNO3)=0.4mol·L-1,c( H2SO4)=0.1mol·L-1,向其中加入1.92 gCu粉,微热充分反应后溶液中的c(Cu2+)为
| A.0.15 mol·L-1 | B.0. 225 mol·L-1 | C.0.3 mol·L-1 | D.无法计算 |
下列现象或反应的原理解释正确的是
| 选项 |
现象或反应 |
原理解释 |
| A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝导热性强,温度达不到着火点 |
| B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| c |
向某溶液中加入盐酸酸化的氯化钡溶液, 有白色沉淀生成 |
该溶液中不一定含有S04一 |
| D |
铜与浓硝酸反应生成N02,而与稀硝酸 反应生成NO |
浓硝酸的氧化性弱于稀硝酸的氧化性 |