分别在[H+]=1×10-1摩/升的酸溶液和[OH-]=1摩/升NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
| A.两种溶液的体积相同,酸是多元强酸 |
| B.两种溶液的体积相同,酸是弱酸 |
| C.酸溶液的体积比NaOH溶液的体积大 |
| D.酸是强酸,且酸溶液浓度比NaOH溶液的浓度大 |
在25℃时,某稀溶液中由水电离产生的c(OH-)水=10-11mol/L。下列有关该溶液的叙述正确的是
| A.该溶液一定呈酸性 |
| B.该溶液中的c(H+)肯定等于10-3mol/L |
| C.该溶液的pH可能为3,可能为11 |
| D.该溶液一定呈碱性 |
25℃和1.01×105 Pa时,反应2N2O5 (g) = 4NO2 (g)+O2 (g) ΔH=+56.76kJ/mol自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应 |
已知反应A2(g)+2B2(g)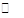 2AB2(g)的ΔH<0,下列说法正确的是
2AB2(g)的ΔH<0,下列说法正确的是
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
对于合成氨工业来说,下列叙述中正确的是
| A.使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B.使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C.采用循环操作,能提高NH3的平衡浓度 |
| D.采用循环操作,能加快反应速率 |
下列说法正确的是
| A.干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B.凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D.明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |