【3分】下列反应的现象描述与离子方程式都正确的是( )
| A.金属镁与稀盐酸反应:有氢气产生Mg+2H++2Cl-====MgCl2+H2↑ |
B.氯化钡溶液与硫酸反应:有白色沉淀生成Ba2++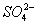 ====BaSO4↓ ====BaSO4↓ |
| C.碳酸钠溶液与盐酸反应:有气泡逸出Na2CO3+2H+====2Na++CO2↑+H2O |
| D.过量铁粉与氯化铁溶液反应:溶液变浅绿色Fe+Fe3+====2Fe2+ |
下列各项中物质的类别不正确的是( )
| A |
B |
C |
D |
| Al2O3 |
Si |
Na2O2 |
Na2SiO3 |
| 两性氧化物 |
单质 |
碱性氧化物 |
硅酸盐 |
下列有关物质性质的应用正确的是( )
| A.液氨汽化时要吸收大量的热,可用作制冷剂 |
| B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C.生石灰能与水反应,可用来干燥氯气 |
| D.氯化铝是一种电解质,可用于电解法制铝 |
下列实验的现象与对应结论均正确的是( )
| 选项 |
操作 |
现象 |
结论 |
| A |
将浓硫酸滴到蔗糖表面 |
固体变黑膨胀 |
浓硫酸有脱水性和强氧化性 |
| B |
常温下将Al片放入浓硝酸中 |
无明显现象 |
Al与浓硝酸不反应 |
| C |
将一小块Na放入无水乙醇中 |
产生气泡 |
Na能置换出醇羟基中的氢 |
| D |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C ΔH<0从熵变角度看,可以自发进行 2MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀释相同倍数,BX溶液的pH变化小于BY溶液 |
| D.电离平衡常数K(BOH)小于K(HY) |