可逆反应aA(?)+2 B(g) 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( ) 
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
环境问题是实现科学发展必须正确面对的问题,下列说法不正确的是
| A.煤经气化和液化两个物理过程,可变为清洁能源 |
| B.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关 |
| C.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
| D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是
| A.54.5% | B.40% | C.36% | D.33.3% |
现有0.4mol·L-1HA溶液和0.2mol·L-1NaOH溶液等体积混合组成溶液。下列有关推论不正确的是
A.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
B.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
C.若该溶液中HA电离能力大于A-水解能力,则有c(A'>c(Na+)>c(HA)>c(H)>c(OH-)
D.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(Na+)>c(HA)>c(OH-)>c(H+)
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH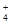 、Ba2+、Cl-、CO32-、SO42-。
、Ba2+、Cl-、CO32-、SO42-。
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验事实,以下推测中正确的是
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和ⅡA族,碱性:CsOH >Ba(OH)2 |