自然界中已发现的100多种元素里,金属元素约占 ,其中含量最多的元素是 ,含量最多的金属元素是 。金属导电靠 ,电解质溶液导电靠 ,金属导电能力随温度升高而 ,溶液导电能力随温度升高而 。
已知某物质主要成分的化学式为XY2,X原子的结构示意图为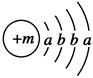 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该物质主要成分的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
| A.XY2和WZ2都为离子化合物 |
| B.XY2分子中仅含离子键,WZ2中仅含极性共价键 |
| C.H2Z比HY的稳定性强 |
| D.X的阳离子比Y的阴离子半径大 |
(4)下列化学用语表达正确的是________。
(5)水的沸点比H2Z的沸点高,其原因是_________________________________________。
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
①NaCl溶于水时破坏___________________________________;
②HCl溶于水时破坏____________________________________;
③SO2溶于水时破坏____________________________________;
④酒精溶于水时破坏____________________________________;
⑤NaOH和HCl反应时形成_______和_______;
⑥反应2H2+O22H2O中,被破坏的是________,形成的是________;
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
⑧Na2O熔化时被破坏的是________。
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是______,该化合物由______键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是________。
(3)Na3N与水的反应属于____________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或“<”)。
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A__________,C________,D__________,E__________。
(2)用电子式表示B和F形成化合物的过程:__________。
(3)写出A、C、F三种元素最高价氧化物的水化物相互反应的化学方程式__________________,__________________,________________。
A、B、C、D是元素周期表前三周期中的4种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30,D-的核外电子排布与Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1)写出上述四种元素的名称:A__________,B__________,C__________,D__________。
(2)用电子式表示AD2:___________________________________ _____________________________________。
(3)D单质与水反应的化学方程式为_________________________ __________________________________________。